FastKing RT комплект (с gDNase)
Характеристика
■ Висока ефективност: FastKing RT Enzyme е модифициран с хидрофобен мотив, с RT ефективност над 95%.
■ Чувствителен: Шаблоните от 1 ng могат да бъдат точно идентифицирани.
■ Устойчивост: Възможност за обратна транскрипция на сложни шаблони, с перфектна устойчивост на примеси.
■ Гъвкав: Отстраняването на геномна ДНК и обратната транскрипция са завършени отделно. Праймерите се смесват отделно в епруветка, гъвкаво за смяна на други праймери.
Спецификация
Тип: генно модифицирана обратна транскриптаза, gDNase
Процедури: Двустепенна (отстраняване на геномна ДНК и RT)
RT ефективност:> 95%
Шаблон: 1 ng- 2 μg
Време на работа: ~ 21 мин
Приложения: Обратно транскрибираната сДНК може да се използва в конвенционална PCR, PCR в реално време, изграждане на библиотека на кДНК.
21 минути реакция в една епруветка
Отнема само 21 минути, за да завърши отстраняването на gDNA и ефективния процес на обратна транскрипция в същата епруветка, без да се заменя реакционната тръба и независимия процес на третиране с DNase I. В сравнение с традиционния метод, който изисква 12-степенна операция и 140-минутна реакция, той значително опростява операционните стъпки и спестява много време за работа.
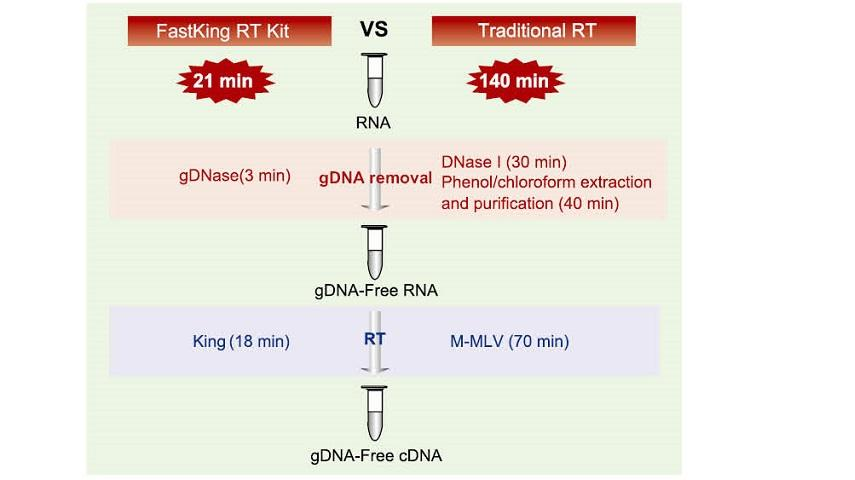
Изключително качество на King RTase
—— Изключително висока ефективност на обратната транскрипция
—— Ефективността на обратната транскрипция е над 95%
Общата обратна транскриптаза има ефективност на обратната транскрипция от 40-60%и добивът на сДНК може да бъде увеличен с по-високо количество на зареждане на РНК. Обратната транскриптаза на King може да постигне ефективност на обратната транскрипция над 95% поради уникалния си висок афинитет към РНК шаблоните. Следователно, последващите експерименти могат да бъдат удовлетворени, без да е необходимо голямо количество РНК вход, което спестява РНК и позволява висока чистота и висок добив на кДНК.
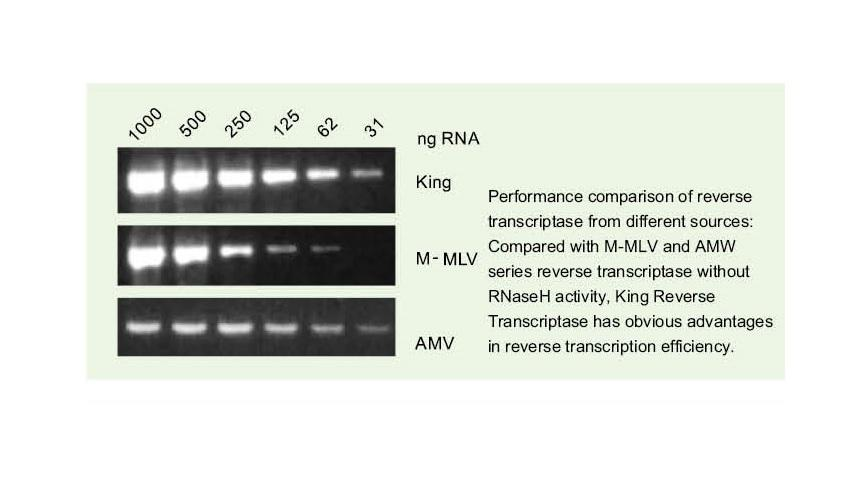
Лесно четене чрез сложни шаблони
—— Лесно се чете чрез високи GC и сложни шаблони
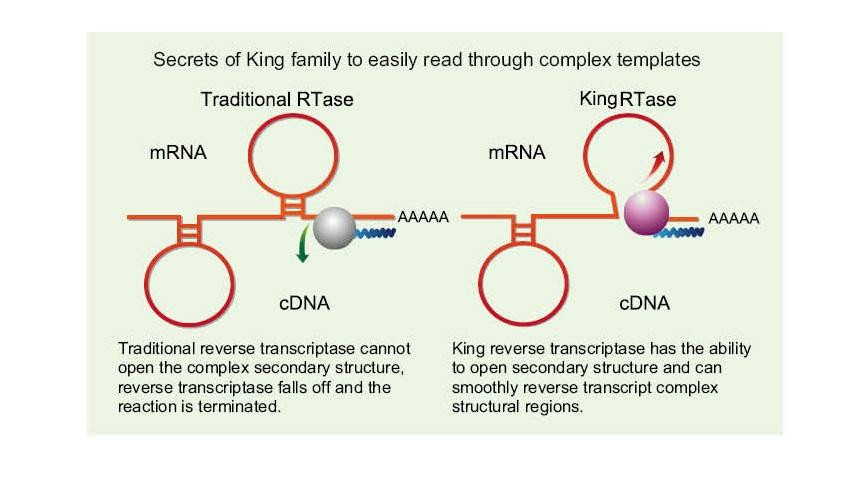
Едноверижната РНК има широк спектър от сложни области на вторична структура, дължащи се на водородна връзка между нишки. Обикновената обратна транскриптаза може да доведе до прекратяване на обратната транскрипция, когато се срещне със сложна вторична структура, като по този начин не може да завърши успешно синтеза на кДНК. Новото поколение на обратната транскриптаза на King има уникален структурен домен, който може да разруши водородната връзка между нишките на РНК, като по този начин отваря сложната вторична структура на РНК и осигурява гладка обратна транскрипция.
Всички продукти могат да бъдат персонализирани за ODM/OEM. За детайли,моля, щракнете върху Персонализирана услуга (ODM/OEM)
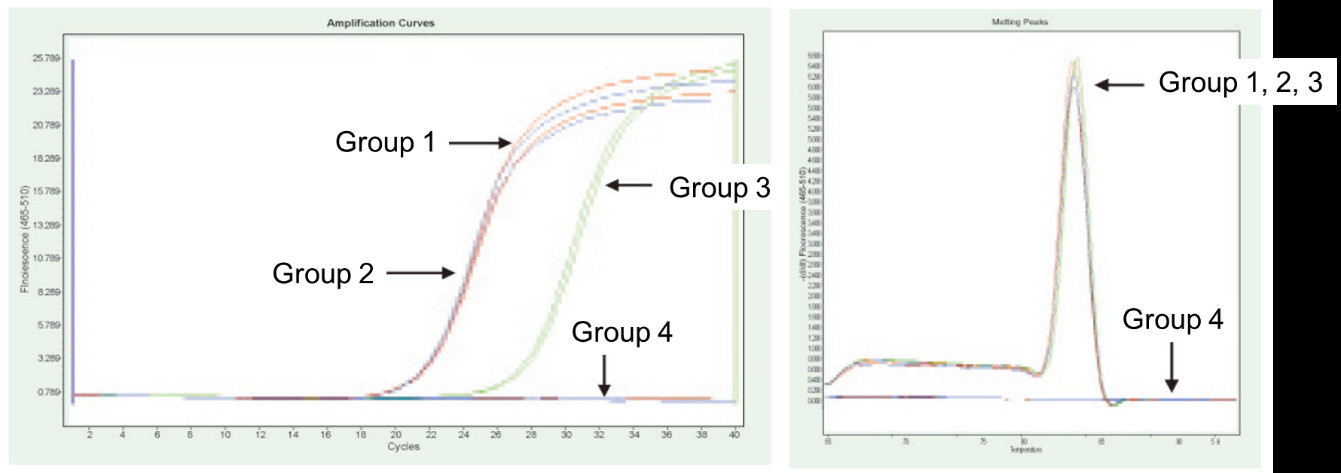 |
Група 1: Обратна транскрипция без лечение с gDNase; Група 2: Без лечение с gDNase и без обратна транскрипция; Група 3: Обратна транскрипция след лечение с gDNase; Група 4: лечение с gDNase без обратна транскрипция. Методи: Флуоресцентно количествено PCR откриване на TNF-алфа гена (праймер, проектиран върху екзон с cDNA или геном като шаблон), като се използва 1 μg РНК на Hela клетки (с геномен остатък) като шаблон. Резултати: Както е показано на фигурата, група 2 може да отразява остатъкът от геном в РНК, група 3 може точно да отразява истинското ниво на експресия на TNF-алфа, група 1 има грешки в крайните количествени резултати поради геномния остатък, а група 4 показва, че FastKing RT Kit може напълно да премахне остатъчната геномна ДНК в РНК. |
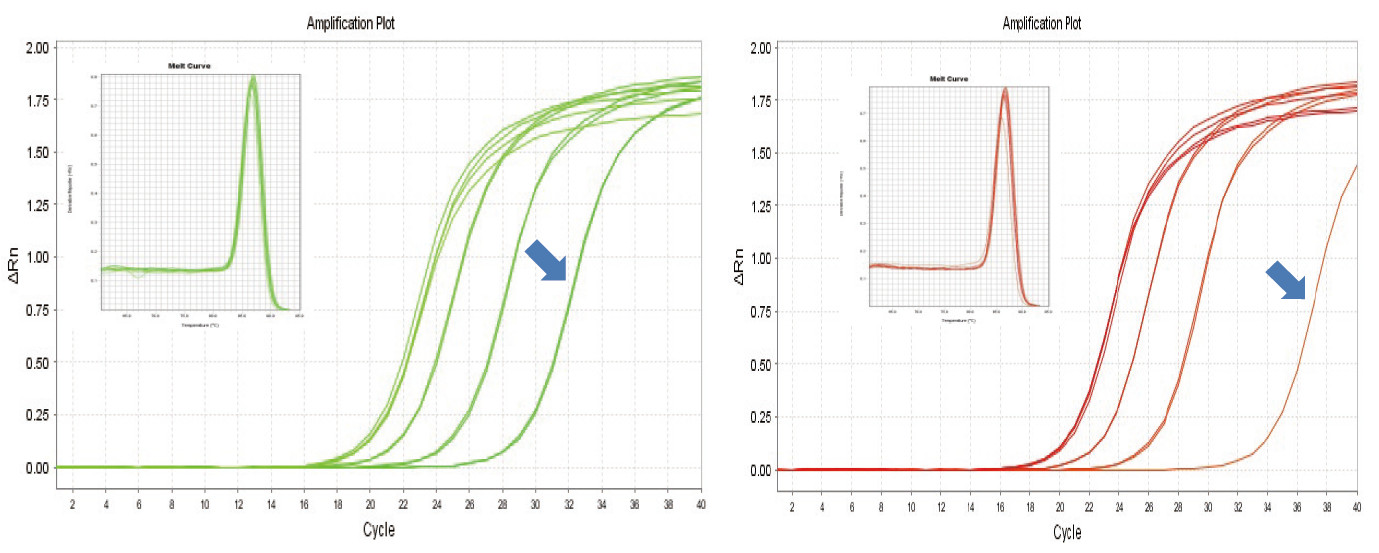 |
Фигура 1. Обратната транскрипция на миши РНК се извършва с помощта на TIANGEN FastKing RT Kit (вляво) и съответния продукт на Доставчик А (вдясно), след което MM5 генът се амплифицира количествено с помощта на TIANGEN SuperReal PreMix Plus (SYBR Green). Кривата на усилване и кривата на топене бяха анализирани. Входният РНК е съответно 1000 ng, 100 ng, 10 ng и 1 ng. Резултатите показват, че TIANGEN FastKing RT Kit има ясен градиент на обратна транскрипция и ниска стойност на Ct и има очевидни предимства за обратна транскрипция на шаблон с ниско изобилие (1 ng, синя стрелка). |
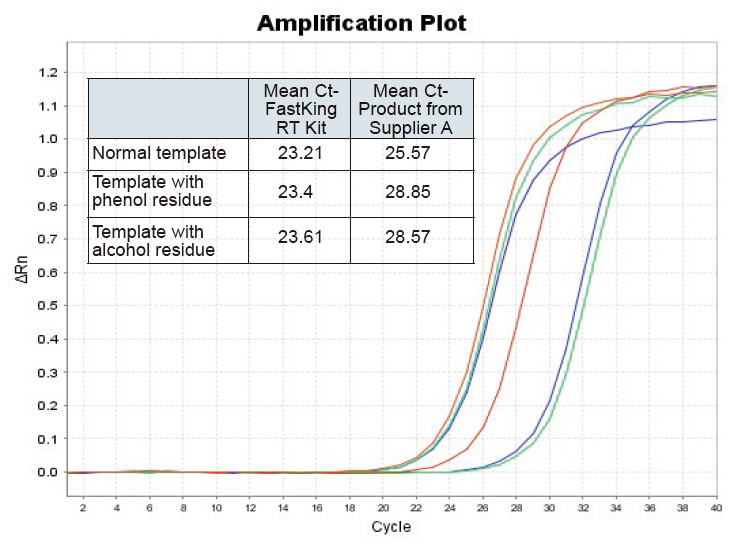 |
Фигура 2. Обратна транскрипция на нормален РНК шаблон (червен), шаблон с голям фенолен остатък (зелен) и шаблон с алкохолен остатък (син) на плъхове, използвайки TIANGEN FastKing RT Kit и съответния продукт на Доставчик А, количествено определяне на RNC гени с помощта на TIANGEN SuperReal Бяха анализирани PreMix Plus (SYBR Green) и кривите на усилване и стойностите на Ct. Резултатите показват, че TIANGEN FastKing RT Kit има най -ниската количествена Ct стойност след обратна транскрипция и отлична устойчивост на стрес и има очевидни предимства за шаблони с високи остатъци от примеси |
А-1 РНК се разгражда
—— Пречистете висококачествена РНК без замърсяване. Материалът, от който се извлича РНК, трябва да бъде възможно най -свеж, за да се предотврати разграждането на РНК. Анализирайте целостта на РНК върху денатуриран гел преди RT реакция. След екстракция на РНК, тя трябва да се съхранява в 100% формамид. Ако се използва инхибитор на RNase, температурата на нагряване трябва да бъде <45 ° C, а рН трябва да бъде по -малко от 8,0, в противен случай инхибиторът ще освободи цялата свързана RNase. Освен това, инхибиторът на RNase трябва да се добави в разтвори, съдържащи ≥ 0,8 тМ DTT.
А-2 РНК съдържа инхибитори на реакциите на обратна транскрипция
—— Инхибиторите на обратната транскрипция включват SDS, EDTA, глицерол, натриев пирофосфат, спермидин, формамид, гуанидинова сол и др. Смесете контролната РНК с пробата и сравнете добива с контролната РНК реакция, за да проверите дали има инхибитор. Измийте РНК утаяването със 70% (об./Об.) Етанол, за да отстраните инхибиторите.
А-3 Недостатъчно отгряване на праймери, използвани за синтезиране на първата верига на сДНК
—— Определете дали температурата на отгряване е подходяща за грундовете, използвани в експеримента. За случайни хексамери се препоръчва да се поддържа температурата при 25 ° C в продължение на 10 минути, преди да се достигне реакционната температура. За ген-специфични праймери (GSP) опитайте друг GSP или преминете към олиго (dT) или произволен хексамер.
А-4 Малко количество изходна РНК
—— Увеличете количеството на РНК. За проби от РНК по -малко от 50 ng, 0,1 μg до 0,5 μg ацетил BSA може да се използва в синтеза на сдНК на първата верига
А-5 Прицелната последователност не се експресира в анализираните тъкани.
—— Опитайте други тъкани.
А-6 PCR реакцията е неуспешна
—— За двуетапна RT-PCR, сДНК матрицата в стъпката PCR не може да надвишава 1/5 от реакционния обем.
A-1 Неспецифично отгряване на грундове и шаблони
—— 3'-краят на праймерите не трябва да съдържа 2-3 dG или dC. Използвайте генно-специфични праймери в синтеза на първата верига вместо произволни праймери или олиго (dT). Използвайте по -висока температура на отгряване през първите няколко цикъла и след това по -ниска температура на отгряване. Използвайте Taq DNA полимераза с горещ старт за PCR, за да подобрите специфичността на реакцията.
А-2 Лош дизайн на генно-специфични праймери
—— Следвайте същите принципи за дизайн на усилващ праймер.
А-3 РНК, замърсена с геномна ДНК
—— Лекувайте РНК с ДНКаза от клас PCR. Настройте контролна реакция без обратна транскрипция, за да откриете ДНК замърсяване.
А-4 Образуване на грунд димер
—— Проектирайте праймери без допълващи се последователности в 3 'края.
А-5 Твърде висок Mg2+ концентрация
—— Оптимизирайте Mg2+ концентрация за всяка комбинация от шаблон и грунд
А-6 Замърсен с чужда ДНК
—— Използвайте аерозолно устойчиви накрайници и UDG ензими.
A-1 Съдържанието на продукта от първата нишка е твърде високо
—— Намалете количеството на продукта от първата верига в конвенционалния етап на PCR реакция.
А-2 Твърде голямо количество праймер в PCR реакция
—— Намаляване на въвеждането на грунд.
A-3 Твърде много цикли
—— Оптимизирайте условията на PCR реакция и намалете броя на PCR цикъла.
A-4 Твърде ниска температура на отгряване
—— Увеличете температурата на отгряване, за да предотвратите неспецифично иницииране и удължаване.
А-5 Неспецифична амплификация на олигонуклеотидни фрагменти, генерирани от разграждане на ДНКаза на ДНК--Извличане на висококачествена РНК, за да се предотврати ДНК замърсяване.
RT-PCR трябва да обърне обратно транскрибираната РНК в сДНК и след това да използва обратно транскрибираната сДНК като шаблон за PCR реакция за амплифициране на целевия фрагмент. Изберете произволни праймери, Oligo dT и генно специфични праймери според специфичните условия на експеримента. Всички горни праймери могат да се използват за къса еукариотна клетъчна иРНК без структура на фиби.
Случайни праймери: Подходящи за дълга РНК със структура на фиби, както и за всички видове РНК като рРНК, иРНК, тРНК и др. Те се използват главно за RT-PCR реакция на единичен шаблон.
Oligo dT: Подходящ за РНК с PolyA опашка (прокариотна РНК, еукариотна Oligo dT рРНК и тРНК нямат PolyA опашки). Тъй като Oligo dT е свързан с опашката на PolyA, качеството на пробите от РНК се изисква да бъде високо и дори малко количество разграждане ще намали значително количеството на синтеза на кДНК с пълна дължина.
Ген-специфичен праймер: В допълнение към последователността на шаблона, подходящ за ситуации, в които целевата последователност е известна.
Има два начина:
1. Вътрешен референтен метод: На теория сДНК е ДНК фрагменти с различна дължина, така че резултатът от електрофорезата е намазка. Ако изобилието на РНК е ниско, никой продукт няма да се покаже при електрофореза, но това не означава, че нито един продукт няма да бъде амплифициран чрез PCR. Като цяло, вътрешна справка може да се използва за откриване на кДНК. Ако вътрешната справка има резултати, качеството на сДНК може да бъде гарантирано основно (в няколко случая, ако фрагментът на целевия ген е твърде дълъг, може да има изключения).
2. Ако има известен ген, амплифициран от този шаблон, той може да бъде проверен от праймерите на този ген. Усилването на вътрешната референция не означава непременно, че няма проблем с кДНК. Тъй като вътрешната референция има голямо изобилие в кДНК, тя е лесна за усилване. Ако сДНК е частично разградена по различни причини, от гледна точка на вероятността, резултатите от PCR на гените -мишени с ниско изобилие ще бъдат силно засегнати. Докато вътрешната референция все още е в изобилие, усилването вероятно няма да бъде засегнато.
Частично разграждане на РНК. Откриване на целостта и пречистване на РНК
Съдържанието на РНК при различни видове може да е различно, но като цяло извлечената обща РНК трябва да съдържа две ясни ленти 28S и 18S в гел електрофореза, а яркостта на първата лента трябва да бъде два пъти по -висока от тази на втората. Лентата 5S показва, че РНК е разградена и яркостта й е пропорционална на степента на разграждане. Успешното усилване на вътрешната референция не означава, че няма проблем с РНК, тъй като вътрешната референция е в голямо изобилие, РНК може да бъде усилена, стига разграждането да не е силно. OD260/OD280съотношението на чистата РНК, измерено със спектрофотометър, трябва да бъде между 1,9 и 2,1. Малко количество протеинови примеси в РНК ще намали съотношението. Докато стойността не е твърде ниска, RT няма да бъде засегната. Най -важното за RT е целостта на РНК.
Удължаването на вътрешния референтен ген може само да показва, че RT е успял, но не е задължително свързано с качеството на сДНК веригата. Тъй като вътрешните референтни фрагменти обикновено са малки по размер и с висока експресия, те са по -лесни за успех при обратна транскрипция. Размерът и експресията на целевия ген обаче варират от ген до ген. Качеството на кДНК не може да бъде оценено само чрез вътрешна справка, особено за целевите фрагменти, по -дълги от 2 kb.
Някои проби имат сложни вторични структури или имат богато съдържание на GC или са ценни с ниско изобилие. В тези случаи трябва да се избере подходяща обратна транскриптаза според размера на целевия фрагмент и пробата. За РНК шаблони с високо съдържание на GC и сложна вторична структура е трудно да се отвори вторичната структура при ниска температура или с обикновена обратна транскриптаза. За тези шаблони може да бъде избрана Quant обратна транскриптаза, тъй като нейната ефективност на обратната транскрипция е очевидно по-добра от тази на обратната транскриптаза от серията M-MLV, която може ефективно да транскрибира различни РНК шаблони и да транскрибира РНК в първа верига сДНК в максимална степен. Когато се използва общ комплект за обратна транскриптаза, 20 μl система може ефективно ефективно да транскрибира 1 μg от общата РНК. Моля, обърнете внимание на максималния RT капацитет на комплекта. Ако шаблонът се добави в излишък, обратната транскрипция ще благоприятства РНК с голямо изобилие. Ето защо е по -добре да не превишавате максималния капацитет на системата.
A-1 Определете дали РНК е силно разградена и дали RT е успешна
Като цяло, причината за неуспеха на вътрешното референтно усилване често се причинява от сериозно разграждане на РНК. Друга възможна причина е неуспехът на обратната транскрипция. Вътрешната референция не може да се използва като стандарт за преценка на качеството на единичната верига на кДНК, но може да се използва като стандарт за преценка дали обратната транскрипция е успешна, ако няма проблем с качеството на РНК. Най -важното в процеса на обратна транскрипция е да се поддържа постоянна температура и постоянна реакционна система, за да се подобри ефективността на реакцията.
А-2 Определете дали праймерите за амплифициране на вътрешни референтни гени са надеждни и дали има проблеми с реагентите, използвани в PCR.
За относително количествено определяне, РНК трябва да бъде количествено определена преди обратна транскрипция, което също се изисква в много комплекти за обратна транскрипция, например, количествено да се определи входната РНК като 1 μg. Тъй като обратно транскрибираната сДНК е смесен разтвор, включващ РНК, олиго dT, ензим, dNTP и дори малко ДНК остатък, ще бъде причинено отклонение, така че е невъзможно точно да се определи количествено кДНК. Следователно е необходимо количествено определяне на РНК. Като се има предвид, че ефективността на обратната транскрипция е еднаква при различните проби, количеството на получената сДНК трябва да бъде същото и количественият анализ може да покаже сравнението на нивата на експресия на различни гени в същото количество обща РНК. При извършване на относителна флуоресцентна количествена PCR количествена сДНК може да не се изисква след обратна транскрипция, тъй като вътрешният референтен ген може да действа като референтен.
Той е свързан главно с гените и обратната транскрипция на дълъг фрагмент не е възможна за повечето гени. Първо, ефективността на обратната транскрипция е далеч по -ниска от тази на PCR. Второ, богатият на GC регион и вторичната структура на много гени ограничават както обратната транскрипция, така и PCR. И накрая, верността и ефективността на амплификацията на PCR са трудни за гарантиране едновременно. В процеса на обратна транскрипция никой не може да гарантира, че ще получи дълъг фрагмент за гени с ниско копие, особено използвайки oligo dT. Що се отнася до 5 'UTR с повече GC, това е още по -трудно. Следователно, все още е разумен метод да се обърне транскрипция със случайни праймери, да се намерят естествените места на разцепване в целевия фрагмент, да се амплифицира по сегменти и след това да се извърши рестрикционното смилане и лигиране. Като цяло е трудно директно да се амплифицират фрагменти, по -големи от 2 kb, но не винаги е невъзможно да се получат: 1. На първо място, гарантирайте целостта на РНК/тРНК и се предпочита екстракцията на TRIZOL. 2. Комплектът M-MLV RT-PCR може да се използва директно. Удължете времето за отгряване и увеличете правилно броя на циклите в процеса на усилване. Алтернативно, може да се приложи вложен PCR или първо да се извършат една или две реакции с подходящо удължено време на денатурация и удължаване преди нормална PCR амплификация, което може да помогне за удължаване на фрагментите. Обърнете внимание на верността на полимеразата. 3. Long Taq може да се използва в PCR за получаване на идеални резултати. 4. За прилагане на експресия на протеин трябва да се прилага полимераза с висока вярност.
Има два вида обратна транскриптаза, предлагани от TIANGEN: Quant/King RTase и TIANScript M-MLV. Основната разлика между тях е вложеното количество шаблони. Quant е уникална обратна транскриптаза, която е различна от често използваната M-MLV, получена от вируса на миша левкемия на Moloney. Quant е нова високоефективна обратна транскриптаза, рекомбинантно експресирана от инженерната Escherichia coli. Quant е подходящ за амплифициране на 50 ng-2 μg РНК с висока обратна транскрипционна активност и висок добив. В сравнение с обикновените MMLV или AMV, най -голямата характеристика на Quant е, че той има много силен афинитет към РНК шаблоните и може да обърне сложни шаблони за транскрипция без денатурация при висока температура. За шаблони с по -високо съдържание на GC, обратната ефективност е по -висока. Тази обратна транскриптаза обаче има RNase Н активност, която може да повлияе на дължината на сДНК продукта (подходящ за <4.5 kb шаблони). За конвенционална обратна транскрипция се препоръчва обратна транскриптаза на TIANScript MMLV. Тази RTase е модифициран ензим с много слаба активност на RNase H, който е подходящ за дълъг (> 5 kb) синтез на кДНК.
Едноетапната обратна транскрипция и PCR амплификация се завършват в същата епруветка, без да се отваря капачката на тръбата между синтеза и амплификацията на кДНК, което е полезно за намаляване на замърсяването. Тъй като всички получени проби от кДНК се използват за амплификация, чувствителността е по -висока, с минимум 0,01 pg от общата РНК. За успешен едноетапен RTPCR, генно-специфични праймери обикновено се използват за иницииране на синтез на кДНК. Двустепенният метод, а именно обратна транскрипция и PCR амплификация, се извършва на два етапа. Първо се извършва обратна транскрипция от РНК матрица за получаване на сДНК и получената сДНК се подлага на една или повече различни PCR реакции. Двустепенният метод може да използва олиго (dT) или произволни праймери за насочване на синтеза на първата верига на сДНК и може да транскрибира цялата информация за тРНК от конкретна проба.
Категории продукти
ЗАЩО ИЗБЕРЕТЕ НАС
От създаването си нашата фабрика разработва първокласни продукти с придържане към принципа
първо качество. Нашите продукти са спечелили отлична репутация в индустрията и ценно доверие сред нови и стари клиенти.










