Комплект TIANScriptⅡ RT
Характеристика
■ Висока ензимна активност и ефективност: Висока активност на обратната транскриптаза и добра съвместимост в следващите експерименти.
■ Широк диапазон на субстрат: Подходящ за всички РНК, особено РНК шаблони със сложни вторични структури.
■ Дълга RT дължина: Синтезът на първата нишка на cDNA може да достигне 12 kb.
■ Лесна работа: Просто добавете необходимите компоненти в една стъпка, без да добавяте реагент по време на операцията.
Приложения
■ Синтез на първа верига на кДНК.
■ Изграждане на cDNA библиотека.
■ Едноетапен RT-PCR.
■ RACE анализ.
Всички продукти могат да бъдат персонализирани за ODM/OEM. За детайли,моля, щракнете върху Персонализирана услуга (ODM/OEM)
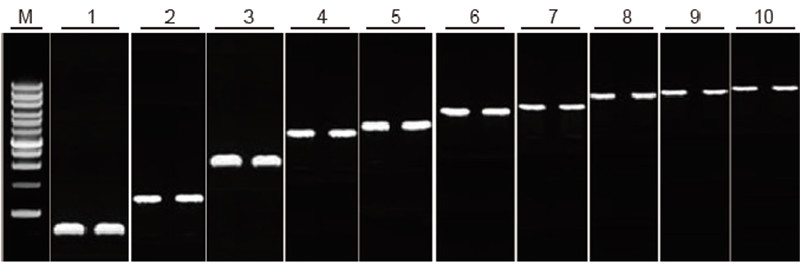 |
Възможност за обратна транскрипция на TIANScript II RT Kit за фрагменти с различна дължина Метод: Обратна транскрипция: Вижте ръководството за употреба на TIANScript II RT Kit. Резултати: Геловата картина показва резултатите от амплификацията на 10 целеви гена с различна дължина след обратна транскрипция на 1 μg от общата РНК. Зареждат се 2 μl продукти с обратна транскрипция на лента. Амплификационна система (PCR): 20 μl; Натоварване на пробата: 5 μl; Маркер: D15000+1 kb ДНК стълба; Концентрация на гел: 1%; Условия на електрофореза: 6 V/cm, 20 min Диаграма на всяка лента: М: ДНК маркер; 1: Дължина на продукта: 120 bp; 2: Дължина на продукта: 1 kb; 3: Дължина на продукта: 2,5 kb; 4: Дължина на продукта: 3,2 kb; 5: Продукт дължина: 4,6 kb; 6: Дължина на продукта: 6.8 kb; 7: Дължина на продукта: 7.6 kb; 8: Дължина на продукта: 8.9 kb; 9: Дължина на продукта: 10 kb; 10: Дължина на продукта: 12 kb; |
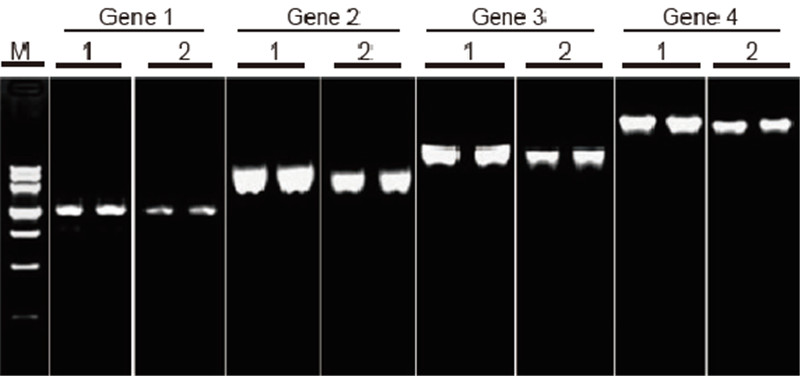 |
Сравнение на ефективността и специфичността на TIANScript II RT Kit и продукти от други доставчици при обратна транскрипция на дълги шаблони Материали: Обща РНК на прилепнали човешки клетки. Изходно количество RT-PCR: 2 μl продукт с обратна транскрипция (50 ng/μl) Метод: Обратна транскрипция: Вижте ръководството за употреба на TIANScript II RT Kit. Резултати: Геловата картина показва резултатите от амплификацията на 6 целеви гена с различна дължина след обратна транскрипция на 1 μg обща РНК на човешки адхезивни клетки, използвайки M-MLV от Доставчик А и TIANGEN TIANScript II RT Kit. Амплификационна система (PCR): 20 μl; Натоварване на пробата: 5 μl; Маркер: ДНК маркер III; Концентрация на гел: 1%; Условия на електрофореза: 6 V/cm, 20 минути. Диаграма на всяка лента: М: ДНК маркер; 1: Резултати от амплификацията на обратната транскрибирана сДНК, използваща TIANScriptII RT Kit; 2. Резултати от амплификацията на обратната транскрипция на кДНК, използвайки съответния продукт от Доставчик А. Дължината на продукта 1 ген е 1,3 kb; Дължината на продукта 2 ген е 3.0kb; Дължината на продукта 3 ген е 5,0 kb; Дължината на продукта 4 ген е 7,5 kb. |
А-1 РНК се разгражда
—— Пречистете висококачествена РНК без замърсяване. Материалът, от който се извлича РНК, трябва да бъде възможно най -свеж, за да се предотврати разграждането на РНК. Анализирайте целостта на РНК върху денатуриран гел преди RT реакция. След екстракция на РНК, тя трябва да се съхранява в 100% формамид. Ако се използва инхибитор на RNase, температурата на нагряване трябва да бъде <45 ° C, а рН трябва да бъде по -малко от 8,0, в противен случай инхибиторът ще освободи цялата свързана RNase. Освен това, инхибиторът на RNase трябва да се добави в разтвори, съдържащи ≥ 0,8 тМ DTT.
А-2 РНК съдържа инхибитори на реакциите на обратна транскрипция
—— Инхибиторите на обратната транскрипция включват SDS, EDTA, глицерол, натриев пирофосфат, спермидин, формамид, гуанидинова сол и др. Смесете контролната РНК с пробата и сравнете добива с контролната РНК реакция, за да проверите дали има инхибитор. Измийте РНК утаяването със 70% (об./Об.) Етанол, за да отстраните инхибиторите.
А-3 Недостатъчно отгряване на праймери, използвани за синтезиране на първата верига на сДНК
—— Определете дали температурата на отгряване е подходяща за грундовете, използвани в експеримента. За случайни хексамери се препоръчва да се поддържа температурата при 25 ° C в продължение на 10 минути, преди да се достигне реакционната температура. За ген-специфични праймери (GSP) опитайте друг GSP или преминете към олиго (dT) или произволен хексамер.
А-4 Малко количество изходна РНК
—— Увеличете количеството на РНК. За проби от РНК по -малко от 50 ng, 0,1 μg до 0,5 μg ацетил BSA може да се използва в синтеза на сдНК на първата верига
А-5 Прицелната последователност не се експресира в анализираните тъкани.
—— Опитайте други тъкани.
А-6 PCR реакцията е неуспешна
—— За двуетапна RT-PCR, сДНК матрицата в стъпката PCR не може да надвишава 1/5 от реакционния обем.
A-1 Неспецифично отгряване на грундове и шаблони
—— 3'-краят на праймерите не трябва да съдържа 2-3 dG или dC. Използвайте генно-специфични праймери в синтеза на първата верига вместо произволни праймери или олиго (dT). Използвайте по -висока температура на отгряване през първите няколко цикъла и след това по -ниска температура на отгряване. Използвайте Taq DNA полимераза с горещ старт за PCR, за да подобрите специфичността на реакцията.
А-2 Лош дизайн на генно-специфични праймери
—— Следвайте същите принципи за дизайн на усилващ праймер.
А-3 РНК, замърсена с геномна ДНК
—— Лекувайте РНК с ДНКаза от клас PCR. Настройте контролна реакция без обратна транскрипция, за да откриете ДНК замърсяване.
А-4 Образуване на грунд димер
—— Проектирайте праймери без допълващи се последователности в 3 'края.
А-5 Твърде висок Mg2+ концентрация
—— Оптимизирайте Mg2+ концентрация за всяка комбинация от шаблон и грунд
А-6 Замърсен с чужда ДНК
—— Използвайте аерозолно устойчиви накрайници и UDG ензими.
A-1 Съдържанието на продукта от първата нишка е твърде високо
—— Намалете количеството на продукта от първата верига в конвенционалния етап на PCR реакция.
А-2 Твърде голямо количество праймер в PCR реакция
—— Намаляване на въвеждането на грунд.
A-3 Твърде много цикли
—— Оптимизирайте условията на PCR реакция и намалете броя на PCR цикъла.
A-4 Твърде ниска температура на отгряване
—— Увеличете температурата на отгряване, за да предотвратите неспецифично иницииране и удължаване.
А-5 Неспецифична амплификация на олигонуклеотидни фрагменти, генерирани от разграждане на ДНКаза на ДНК--Извличане на висококачествена РНК, за да се предотврати ДНК замърсяване.
RT-PCR трябва да обърне обратно транскрибираната РНК в сДНК и след това да използва обратно транскрибираната сДНК като шаблон за PCR реакция за амплифициране на целевия фрагмент. Изберете произволни праймери, Oligo dT и генно специфични праймери според специфичните условия на експеримента. Всички горни праймери могат да се използват за къса еукариотна клетъчна иРНК без структура на фиби.
Случайни праймери: Подходящи за дълга РНК със структура на фиби, както и за всички видове РНК като рРНК, иРНК, тРНК и др. Те се използват главно за RT-PCR реакция на единичен шаблон.
Oligo dT: Подходящ за РНК с PolyA опашка (прокариотна РНК, еукариотна Oligo dT рРНК и тРНК нямат PolyA опашки). Тъй като Oligo dT е свързан с опашката на PolyA, качеството на пробите от РНК се изисква да бъде високо и дори малко количество разграждане ще намали значително количеството на синтеза на кДНК с пълна дължина.
Ген-специфичен праймер: В допълнение към последователността на шаблона, подходящ за ситуации, в които целевата последователност е известна.
Има два начина:
1. Вътрешен референтен метод: На теория сДНК е ДНК фрагменти с различна дължина, така че резултатът от електрофорезата е намазка. Ако изобилието на РНК е ниско, никой продукт няма да се покаже при електрофореза, но това не означава, че нито един продукт няма да бъде амплифициран чрез PCR. Като цяло, вътрешна справка може да се използва за откриване на кДНК. Ако вътрешната справка има резултати, качеството на сДНК може да бъде гарантирано основно (в няколко случая, ако фрагментът на целевия ген е твърде дълъг, може да има изключения).
2. Ако има известен ген, амплифициран от този шаблон, той може да бъде проверен от праймерите на този ген. Усилването на вътрешната референция не означава непременно, че няма проблем с кДНК. Тъй като вътрешната референция има голямо изобилие в кДНК, тя е лесна за усилване. Ако сДНК е частично разградена по различни причини, от гледна точка на вероятността, резултатите от PCR на гените -мишени с ниско изобилие ще бъдат силно засегнати. Докато вътрешната референция все още е в изобилие, усилването вероятно няма да бъде засегнато.
Частично разграждане на РНК. Откриване на целостта и пречистване на РНК
Съдържанието на РНК при различни видове може да е различно, но като цяло извлечената обща РНК трябва да съдържа две ясни ленти 28S и 18S в гел електрофореза, а яркостта на първата лента трябва да бъде два пъти по -висока от тази на втората. Лентата 5S показва, че РНК е разградена и яркостта й е пропорционална на степента на разграждане. Успешното усилване на вътрешната референция не означава, че няма проблем с РНК, тъй като вътрешната референция е в голямо изобилие, РНК може да бъде усилена, стига разграждането да не е силно. OD260/OD280съотношението на чистата РНК, измерено със спектрофотометър, трябва да бъде между 1,9 и 2,1. Малко количество протеинови примеси в РНК ще намали съотношението. Докато стойността не е твърде ниска, RT няма да бъде засегната. Най -важното за RT е целостта на РНК.
Удължаването на вътрешния референтен ген може само да показва, че RT е успял, но не е задължително свързано с качеството на сДНК веригата. Тъй като вътрешните референтни фрагменти обикновено са малки по размер и с висока експресия, те са по -лесни за успех при обратна транскрипция. Размерът и експресията на целевия ген обаче варират от ген до ген. Качеството на кДНК не може да бъде оценено само чрез вътрешна справка, особено за целевите фрагменти, по -дълги от 2 kb.
Някои проби имат сложни вторични структури или имат богато съдържание на GC или са ценни с ниско изобилие. В тези случаи трябва да се избере подходяща обратна транскриптаза според размера на целевия фрагмент и пробата. За РНК шаблони с високо съдържание на GC и сложна вторична структура е трудно да се отвори вторичната структура при ниска температура или с обикновена обратна транскриптаза. За тези шаблони може да бъде избрана Quant обратна транскриптаза, тъй като нейната ефективност на обратната транскрипция е очевидно по-добра от тази на обратната транскриптаза от серията M-MLV, която може ефективно да транскрибира различни РНК шаблони и да транскрибира РНК в първа верига сДНК в максимална степен. Когато се използва общ комплект за обратна транскриптаза, 20 μl система може ефективно ефективно да транскрибира 1 μg от общата РНК. Моля, обърнете внимание на максималния RT капацитет на комплекта. Ако шаблонът се добави в излишък, обратната транскрипция ще благоприятства РНК с голямо изобилие. Ето защо е по -добре да не превишавате максималния капацитет на системата.
A-1 Определете дали РНК е силно разградена и дали RT е успешна
Като цяло, причината за неуспеха на вътрешното референтно усилване често се причинява от сериозно разграждане на РНК. Друга възможна причина е неуспехът на обратната транскрипция. Вътрешната референция не може да се използва като стандарт за преценка на качеството на единичната верига на кДНК, но може да се използва като стандарт за преценка дали обратната транскрипция е успешна, ако няма проблем с качеството на РНК. Най -важното в процеса на обратна транскрипция е да се поддържа постоянна температура и постоянна реакционна система, за да се подобри ефективността на реакцията.
А-2 Определете дали праймерите за амплифициране на вътрешни референтни гени са надеждни и дали има проблеми с реагентите, използвани в PCR.
За относително количествено определяне, РНК трябва да бъде количествено определена преди обратна транскрипция, което също се изисква в много комплекти за обратна транскрипция, например, количествено да се определи входната РНК като 1 μg. Тъй като обратно транскрибираната сДНК е смесен разтвор, включващ РНК, олиго dT, ензим, dNTP и дори малко ДНК остатък, ще бъде причинено отклонение, така че е невъзможно точно да се определи количествено кДНК. Следователно е необходимо количествено определяне на РНК. Като се има предвид, че ефективността на обратната транскрипция е еднаква при различните проби, количеството на получената сДНК трябва да бъде същото и количественият анализ може да покаже сравнението на нивата на експресия на различни гени в същото количество обща РНК. При извършване на относителна флуоресцентна количествена PCR количествена сДНК може да не се изисква след обратна транскрипция, тъй като вътрешният референтен ген може да действа като референтен.
Той е свързан главно с гените и обратната транскрипция на дълъг фрагмент не е възможна за повечето гени. Първо, ефективността на обратната транскрипция е далеч по -ниска от тази на PCR. Второ, богатият на GC регион и вторичната структура на много гени ограничават както обратната транскрипция, така и PCR. И накрая, верността и ефективността на амплификацията на PCR са трудни за гарантиране едновременно. В процеса на обратна транскрипция никой не може да гарантира, че ще получи дълъг фрагмент за гени с ниско копие, особено използвайки oligo dT. Що се отнася до 5 'UTR с повече GC, това е още по -трудно. Следователно, все още е разумен метод да се обърне транскрипция със случайни праймери, да се намерят естествените места на разцепване в целевия фрагмент, да се амплифицира по сегменти и след това да се извърши рестрикционното смилане и лигиране. Като цяло е трудно директно да се амплифицират фрагменти, по -големи от 2 kb, но не винаги е невъзможно да се получат: 1. На първо място, гарантирайте целостта на РНК/тРНК и се предпочита екстракцията на TRIZOL. 2. Комплектът M-MLV RT-PCR може да се използва директно. Удължете времето за отгряване и увеличете правилно броя на циклите в процеса на усилване. Алтернативно, може да се приложи вложен PCR или първо да се извършат една или две реакции с подходящо удължено време на денатурация и удължаване преди нормална PCR амплификация, което може да помогне за удължаване на фрагментите. Обърнете внимание на верността на полимеразата. 3. Long Taq може да се използва в PCR за получаване на идеални резултати. 4. За прилагане на експресия на протеин трябва да се прилага полимераза с висока вярност.
Има два вида обратна транскриптаза, предлагани от TIANGEN: Quant/King RTase и TIANScript M-MLV. Основната разлика между тях е вложеното количество шаблони. Quant е уникална обратна транскриптаза, която е различна от често използваната M-MLV, получена от вируса на миша левкемия на Moloney. Quant е нова високоефективна обратна транскриптаза, рекомбинантно експресирана от инженерната Escherichia coli. Quant е подходящ за амплифициране на 50 ng-2 μg РНК с висока обратна транскрипционна активност и висок добив. В сравнение с обикновените MMLV или AMV, най -голямата характеристика на Quant е, че той има много силен афинитет към РНК шаблоните и може да обърне сложни шаблони за транскрипция без денатурация при висока температура. За шаблони с по -високо съдържание на GC, обратната ефективност е по -висока. Тази обратна транскриптаза обаче има RNase Н активност, която може да повлияе на дължината на сДНК продукта (подходящ за <4.5 kb шаблони). За конвенционална обратна транскрипция се препоръчва обратна транскриптаза на TIANScript MMLV. Тази RTase е модифициран ензим с много слаба активност на RNase H, който е подходящ за дълъг (> 5 kb) синтез на кДНК.
Едноетапната обратна транскрипция и PCR амплификация се завършват в същата епруветка, без да се отваря капачката на тръбата между синтеза и амплификацията на кДНК, което е полезно за намаляване на замърсяването. Тъй като всички получени проби от кДНК се използват за амплификация, чувствителността е по -висока, с минимум 0,01 pg от общата РНК. За успешен едноетапен RTPCR, генно-специфични праймери обикновено се използват за иницииране на синтез на кДНК. Двустепенният метод, а именно обратна транскрипция и PCR амплификация, се извършва на два етапа. Първо се извършва обратна транскрипция от РНК матрица за получаване на сДНК и получената сДНК се подлага на една или повече различни PCR реакции. Двустепенният метод може да използва олиго (dT) или произволни праймери за насочване на синтеза на първата верига на сДНК и може да транскрибира цялата информация за тРНК от конкретна проба.
Категории продукти
ЗАЩО ИЗБЕРЕТЕ НАС
От създаването си нашата фабрика разработва първокласни продукти с придържане към принципа
първо качество. Нашите продукти са спечелили отлична репутация в индустрията и ценно доверие сред нови и стари клиенти.








