2 × Taq PCR MasterMix Ⅱ
Характеристика
■ Висока ефективност на амплификация: ДНК фрагменти с различни размери (по -ниски от 5 kb) и източници могат да бъдат амплифицирани ефективно.
■ Висока чувствителност: До 10 pg целеви фрагменти могат да бъдат усилени от геномни шаблони.
■ Висока устойчивост на стрес: За шаблони с високо съдържание на примеси, като грубо екстрахиран шаблон/бактериална култура, целевият фрагмент може лесно да бъде амплифициран. Полимеразната активност няма да бъде повлияна от многократно замразяване и размразяване.
■ Удобен за приложения: Реакционната система е подготвена лесно и бързо. Амплифицираният фрагмент съдържа 3'-краен dA-надвес, което е удобно за клониране на ТА.
Спецификация
Тип: Taq ДНК полимераза
Пример: Пречистен/грубо екстрахиран шаблон/бактериална култура
Шаблон: > 10 стр
Размер на фрагмента: <5 kb
Приложения: PCR амплификация на ДНК фрагменти, ДНК маркиране, удължаване на праймера, определяне на последователността, мащабно откриване на гени, полуколичествени PCR експерименти, откриване на следи от ДНК и др.
Всички продукти могат да бъдат персонализирани за ODM/OEM. За детайли,моля, щракнете върху Персонализирана услуга (ODM/OEM)
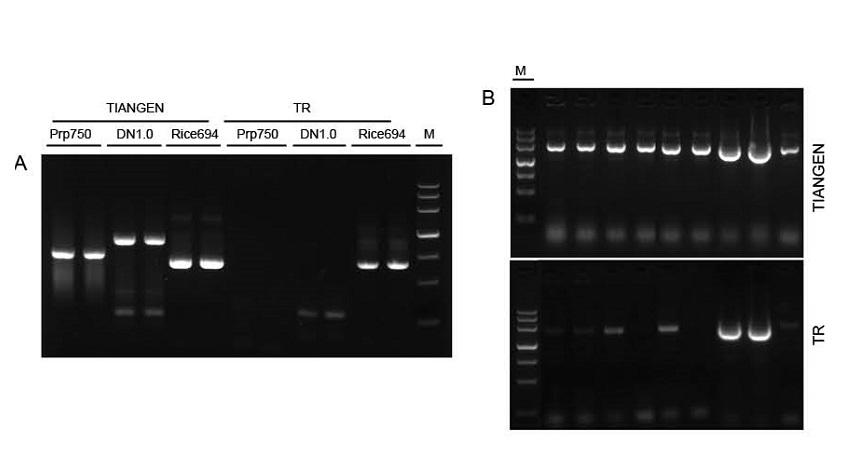 |
Фигура 1. Шаблони от различни източници бяха амплифицирани съответно от TIANGEN Taq MasterMix II и обикновения Taq Mix от доставчик TR за откриване на устойчивостта на стрес на реагентите. Резултатите показват, че продуктите на TIANGEN могат да усилят целевите фрагменти от сурови геномни шаблони и бактериална култура, а устойчивостта на стрес е по -добра от тази на доставчика TR. О: Суров геномен шаблон, извлечен от TIANGEN TIANcombi DNA Lyse & Det PCR Kit. Prp/DN: Сурово извличане и откриване на проби от човешка кръв. Ориз: Екстракция на суров материал и откриване на оризови проби. В: PCR на колония. PCR фрагментът е 700 bp. M: TIANGEN Маркер III |
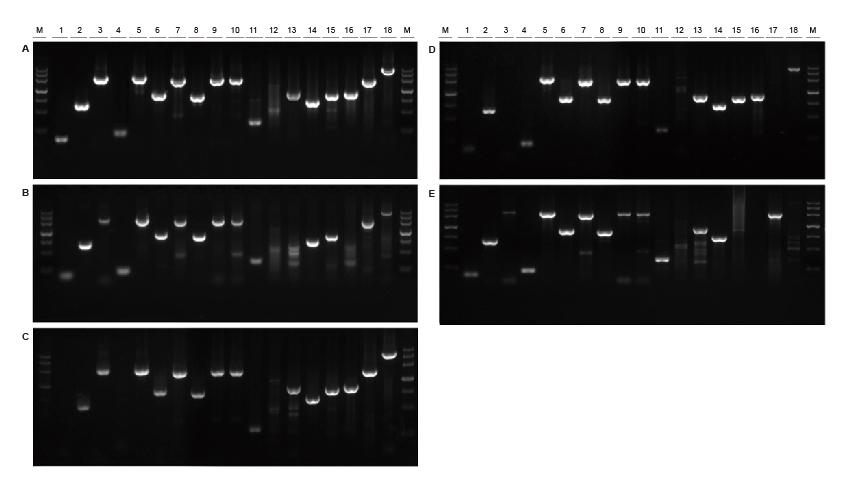 |
Добра универсалност за шаблони от различни източници и с различна дължина Фигура 2. Фрагменти с различни източници и дължини бяха амплифицирани с помощта на TIANGEN Taq MasterMix II (A) и обикновен Taq Смес от доставчик TK (B), доставчик TR (C), доставчик V (D) и доставчик G (E) съответно. Резултатите показват, че цялостното представяне на продуктите на TIANGEN е най -доброто по отношение на възможностите за усилване, специфичността и универсалността.M: TIANGEN Маркер III1: Соева геномна ДНК шаблон (120 bp); 2-3: Матрица за геномна ДНК на ориз (694 bp, 2258 bp); 4: Памучен геномен ДНК шаблон (200 bp); 5: Ешерихия коли матрица за геномна ДНК (2298 bp); 6-7: ДНК шаблон на геном на мишка (1 kb, 2 kb); 8-10: Геномна ДНК матрица на плъх (1 kb, 2 kb, 2080 bp); 11-18: ДНК шаблон на човешки геном (300 bp, 448 bp (GC%: 74.8%), 1100 bp, 750 bp, 1000 bp, 1090 bp (GC%: 70.4%), 2 kb, 4 kb) |
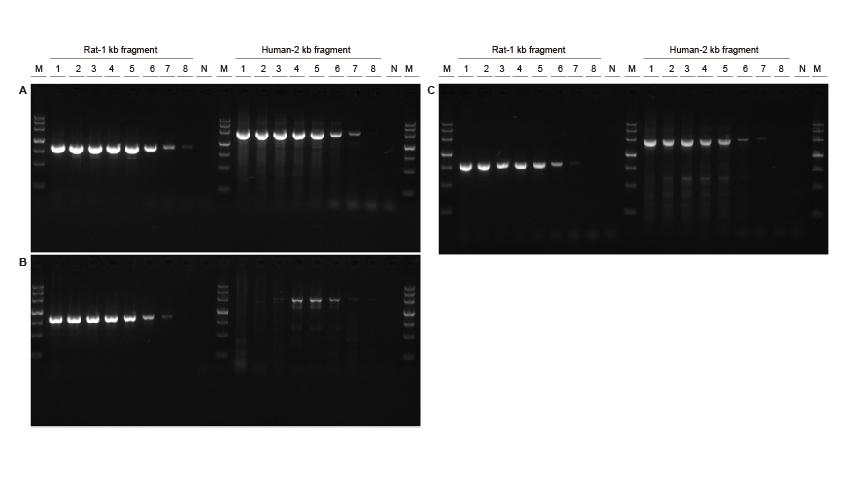 |
Висока чувствителност Фигура 3. Различни концентрации на плъхове и човешки ДНК фрагменти бяха амплифицирани с помощта на TIANGEN Taq MasterMix II (A), обикновен Taq Смес от съответно доставчик V (В) и доставчик ТК (С) за откриване на чувствителността на усилване. Резултатите показват, че продуктът TIANGEN може да усили целевия фрагмент от шаблона на генома до 0,01 ng и неговата чувствителност е по-добра от тази на продуктите от доставчик V и TK.M: TIANGEN Маркер III, N: NTC Вход за шаблон 1-8 : 200 ng, 100 ng, 50 ng, 20 ng, 10 ng, 1 ng, 0.1 ng, 0.01 ng. |
Шаблон А-1
■ Шаблонът съдържа белтъчни примеси или Taq инхибитори и т.н. —— Почистете ДНК матрицата, отстранете протеиновите примеси или извлечете матричната ДНК с комплекти за пречистване.
■ Денатурацията на шаблона не е завършена —— Увеличете подходящо температурата на денатурация и удължете времето за денатурация.
■ Разграждане на шаблона —— Подгответе отново шаблона.
А-2 грунд
■ Лошо качество на грундовете-повторно синтезирайте грунда.
■ Разграждане на праймера - Аликвотирайте грундовете с висока концентрация в малък обем за консервиране. Избягвайте многократно замразяване и размразяване или дългосрочно криоконсервиране при 4 ° C.
■ Неправилен дизайн на грундове (напр. Дължината на грунда не е достатъчна, димер, образуван между грундовете и т.н.)
А-3 Mg2+концентрация
■ Mg2+ концентрацията е твърде ниска —— Правилно увеличете Mg2+ концентрация: Оптимизирайте Mg2+ концентрация чрез серия от реакции от 1 тМ до 3 тМ с интервал от 0,5 тМ за определяне на оптималния Mg2+ концентрация за всеки шаблон и грунд.
A-4 Температура на отгряване
■ Високата температура на отгряване влияе върху свързването на грунд и шаблон. —— Намалете температурата на отгряване и оптимизирайте състоянието с градиент от 2 ° C.
A-5 Време за удължаване
■ Кратко време за удължаване —— Увеличете времето за удължаване.
Феномени: Отрицателните проби също показват лентите на целевата последователност.
А-1 Замърсяване с PCR
■ Кръстосано замърсяване на целевата последователност или продуктите за амплификация - Внимателно да не се пипетира пробата, съдържаща мишена последователност в отрицателната проба, или да се излее от епруветката за центрофуга. Реагентите или оборудването трябва да бъдат автоклавирани, за да се елиминират съществуващите нуклеинови киселини, а наличието на замърсяване трябва да се определи чрез експерименти с отрицателен контрол.
■ Замърсяване с реагенти —— Разпределете реактивите в аликвоти и съхранявайте при ниска температура.
A-2 Primer
■ Mg2+ концентрацията е твърде ниска —— Правилно увеличете Mg2+ концентрация: Оптимизирайте Mg2+ концентрация чрез серия от реакции от 1 тМ до 3 тМ с интервал от 0,5 тМ за определяне на оптималния Mg2+ концентрация за всеки шаблон и грунд.
■ Неправилен дизайн на праймера и целевата последователност има хомология с нецелевата последователност. —— Грундове за повторно проектиране.
Явления: PCR амплификационните ленти са несъвместими с очаквания размер, голям или малък, или понякога се появяват както специфични амплификационни ленти, така и неспецифични амплификационни ленти.
Грунд А-1
■ Лоша специфичност на грунда
—— Грунд за повторно проектиране.
■ Концентрацията на грунда е твърде висока —— Правилно увеличете температурата на денатурация и удължете времето за денатурация.
А-2 мг2+ концентрация
■ Mg2+ концентрацията е твърде висока —— Правилно намалете концентрацията на Mg2+: Оптимизирайте Mg2+ концентрация чрез серия от реакции от 1 тМ до 3 тМ с интервал от 0,5 тМ за определяне на оптималния Mg2+ концентрация за всеки шаблон и грунд.
А-3 Термостабилна полимераза
■ Прекомерно количество ензими —— Намалете подходящо количеството ензими на интервали от 0,5 U.
A-4 Температура на отгряване
■ Температурата на отгряване е твърде ниска-—Подходящо увеличете температурата на отгряване или приемете двустепенния метод на отгряване
А-5 PCR цикли
■ Твърде много PCR цикли —— Намалете броя на PCR циклите.
Грунд А-1—— Лоша специфичност —— Препроектирайте грунда, променете позицията и дължината на грунда, за да подобрите неговата специфичност; или извършете вложен PCR.
А-2 шаблонна ДНК
—— Шаблонът не е чист —— Почистете шаблона или извлечете ДНК с комплекти за пречистване.
А-3 Mg2+ концентрация
——Мг2+ Концентрацията е твърде висока - Правилно намалете Mg2+ концентрация: Оптимизирайте Mg2+ концентрация чрез серия от реакции от 1 тМ до 3 тМ с интервал от 0,5 тМ за определяне на оптималния Mg2+ концентрация за всеки шаблон и грунд.
A-4 dNTP
—— Концентрацията на dNTPs е твърде висока —— Намалете подходящо концентрацията на dNTP
A-5 Температура на отгряване
—— Твърде ниска температура на отгряване ——Подходящо повишаване на температурата на отгряване
А-6 цикли
—— Твърде много цикли ——Оптимизирайте номера на цикъла

Първата стъпка е да изберете подходящата полимераза. Редовната Taq полимераза не може да се коригира поради липса на 3'-5 'екзонуклеазна активност, а несъответствието значително ще намали ефективността на удължаване на фрагментите. Следователно, обикновената Taq полимераза не може ефективно да усили целевите фрагменти, по -големи от 5 kb. Taq полимераза със специална модификация или друга висококачествена полимераза трябва да бъде избрана, за да се подобри ефективността на удължаване и да се отговори на нуждите от амплификация с дълги фрагменти. В допълнение, усилването на дълги фрагменти също изисква съответно регулиране на дизайна на грунда, времето за денатурация, времето за удължаване, рН на буфера и т.н. Обикновено грундовете с 18-24 bp могат да доведат до по-добър добив. За да се предотврати повреда на шаблона, времето за денатурация при 94 ° C трябва да бъде намалено до 30 секунди или по -малко на цикъл, а времето за повишаване на температурата до 94 ° C преди усилване трябва да бъде по -малко от 1 мин. Нещо повече, настройването на температурата на удължаване на около 68 ° C и проектирането на времето за удължаване според скоростта от 1 kb/min може да осигури ефективно усилване на дълги фрагменти.
Степента на грешка при PCR амплификация може да бъде намалена чрез използване на различни ДНК полимерази с висока точност. Сред всички открити досега Taq ДНК полимерази, Pfu ензимът има най -ниската грешка и най -високата вярност (виж приложената таблица). В допълнение към подбора на ензими, изследователите могат допълнително да намалят скоростта на PCR мутация чрез оптимизиране на реакционните условия, включително оптимизиране на състава на буфера, концентрацията на термостабилна полимераза и оптимизиране на броя на PCR цикъла.
Категории продукти
ЗАЩО ИЗБЕРЕТЕ НАС
От създаването си нашата фабрика разработва първокласни продукти с придържане към принципа
първо качество. Нашите продукти са спечелили отлична репутация в индустрията и ценно доверие сред нови и стари клиенти.








